有氢键的常见物质有:HF、NH³与H²O、HNO3、苯丙氨酸的芳香环、邻硝基苯酚分子等。
氢键不嫌缺同于范德华力,它具有饱和性和方向性。由于氢原子特别小而原子A和B比较大,所以A—H中的氢原子只能和一个B原子结合形成氢键。早升同时由于负离子之间的相互排斥,另一个电负性大的原子B′就难于再接近氢原子,这就是氢键的饱和性。
扩展资料:
氢键的特性:
1、熔沸点
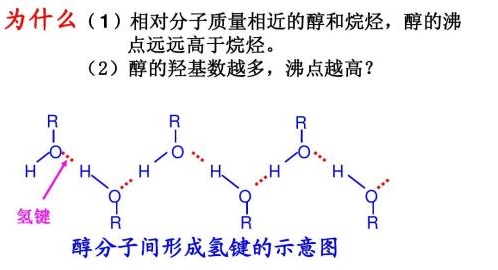
分子间有氢键的物质熔化或气化时,除了要克服纯粹的分子间力外,还必须提高温度,额外地供应一份能量来破坏分子间的氢键,所以这些物质的熔点、沸点比同系列氢化物的熔点、芹睁辩沸点高。
2、溶解度
在极性溶剂中,如果溶质分子与溶剂分子之间可以形成氢键,则溶质的溶解度增大。HF和NH3在水中的溶解度比较大,就是这个缘故。
3、粘度
分子间有氢键的液体,一般粘度较大。例如甘油、磷酸、浓硫酸等多羟基化合物,由于分子间可形成众多的氢键,这些物质通常为粘稠状液体。
4、密度
液体分子间若形成氢键,有可能发生缔合现象,例如液态HF,在通常条件下,除了正常简HF分子外,还有通过氢键联系在一起的复杂分子(HF)n。
参考资料来源:百度百科—氢键
标签:氢键,常见
版权声明:文章由 知识百问 整理收集,来源于互联网或者用户投稿,如有侵权,请联系我们,我们会立即处理。如转载请保留本文链接:https://www.zhshbaiwen.com/answer/21645.html