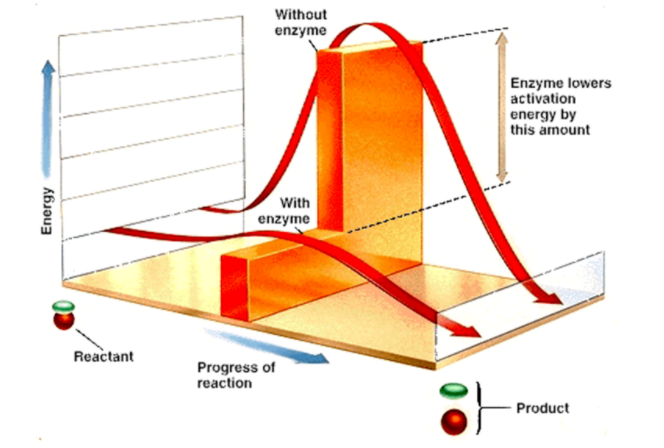
活化能、活化分子与反应速率的关系:活化能是活化分子的平均能量与反应物分子乱弊虚平均能量的差值,活化能是化学反应中由反应物分子到达活化分子所需的最小能量。活化分子浓度越大则反应速率越快。
活化分子数目的多少决定了有哗燃效碰撞发生的次数。在分子数确定时,活化分子百分数增大,有效碰撞的次数增多,反应速率加快。活化分子之间之所以能够发生有效碰撞,破坏分子内部原子之间的“结合力” ,从而导致反应物分子破坏,重新组合成生成物分子,发生化学反应。
扩展资料
反应速率的影响因素:
1、有效碰撞
反应物分子之间的碰撞只有少数碰撞能导致化学反应的发生,多数碰撞并不能导致反应的发生,是无效碰撞。碰撞的频率越高,则化学反应速率就越大。
2、内部因素
不同的化学反应具有不同的反应速率,影响反应速率的主要因素是内因,即参加反应的物质本卜闷身的性质。内因是参加反应的物质的性质和反应的历程,是决定化学反应速率的主要因素。
3、外部因素
当物质确定时 (即内因固定),在同一反应中,影响反应速率的因素是外因,即外界条件,主要有温度、浓度、压强、催化剂等。
参考资料来源:百度百科-反应速率
标签:活化能,活化,速率